Склероз гиппокампа: клиника, диагностика, лечение
Склероз гиппокампа или же склероз Аммонова рога, или же медиальный темпоральный склероз представляет собой совокупность изменений, характеризующихся уменьшением объёма нервной ткани, выпадением нейронов в медиальных отделах височной доли. Клинически склероз гиппокампа проявляется эпилепсией, часто неконтролируемой лекарствами, но в значительном числе случаев излечиваемой хирургически.
Самое первое макроскопическое описание уплотненного и уменьшенного в объеме гиппокампа у больных с эпилепсией было сделано в 1825 году Bouchet и Cazauvieilh. В 1880 году Sommer впервые описал микроскопическую картину склерозированного гиппокампа при эпилепсии, в том числе, отметив что выпадение нейронов в гиппокампе носит сегментарный характер, и наибольшее выпадение нейронов происходит в секторе Зоммера или СА1 сегменте гиппокампа. Клиническое описание эпилептических приступов у больных с патологией височной доли было сделано Hughlings Jackson в 1885 году, а в 1935 году Stauder выявил связь между СГ и клиникой височной эпилепсии. Sano и Malamud в 1953 году подтвердили связь склероза гиппокампа с электроэнцефалографическими признаками височной эпилепсии. В 50 ые годы 20 века с развитием хирургии эпилепсии стало возможна прижизненная диагностика СГ. Так Penfield описал так называемый инцизуральный склероз — уплотнение гиппокампа, амигдалы, крючка, которое отмечалось интраоперационно при хирургии височной эпилепсии. Falconer предложил височную лобэктомию (удаление передних 2/3 неокортекса височной доли и а также медиальных структур) для лечения височной эпилепсии, при этом самым частым гистологическим диагнозом в его серии пациентов был склероз гиппокампа. Позже были предложены более селективные хирургические техники, заключающиеся в удалении лишь медиальных структур височной доли.
На сегодняшний день склероз гиппокампа является самым частым гистологическим диагнозом у взрослых пациентов, оперированных по поводу эпилепсии . Гиппокамп расположен в медиальных отделах височной доли и представляет собой как бы две вложенные друг в друга согнутые полоски нервной ткани: зубчатую извилину и собственно гиппокамп (Аммонов рог или cornu Ammonis (CA)). В гистологическом плане кора гипокампа относится к архикортексу, представленному тремя слоями нейронов. Самый наружный слой гиппокампа, образующий медиальную стенку височного рога бокового желудочка, носит название альвеус и образован аксонами, выходящими из гиппокампа. Далее следует stratum oriens (представленный аксонами и интернейронами), затем слой пирамидальных клеток, которые являются основными клеточными элементами гиппокампа и наконец самый глубокий слой stratum lacunosum и moleculare, представленные дендритами, аксонами и интернейронами. Важной для понимания различных типов поражения Аммонова рога при его склерозе является предложенная Lorente de No разделение пирамидального слоя на 4 сектора (СА1, СА2, СА3 и СА4). Наиболее выраженный слой пирамидальных клеток расположен в СА1 секторе, который продолжается в часть парагиппокампальной извилины, носящую название субикулюм. СА4 слой прилежит к вогнутой части зубчатой извилины. Зубчатая извилина представляет собой С образную структуру, имеющую три слоя клеток: наружный молекулярный, средний гранулярный и внутренний слой полиморфных клеток, которые сливаются с СА4 слоем гиппокампа.
Структурные изменения при склерозе гиппокампа могут варьировать от минимальных, ограниченных одним его СА сектором, до грубых, распространяющихся за пределы медиальной височной доли. Описание патологических изменений структуры мозговой ткани при склерозе гиппокампа отличает исключительное многообразие терминов и наличие нескольких классификаций с различными понятиями, описывающими один и тот же гистологический субстрат.
Гистологическая структура склерозированного гиппокампа
Макроскопически склерозированный гиппокамп уменьшен в объеме и плотный, а среди основных микроскопических характеристик выделяются уменьшение числа пирамидальных клеток в различных СА слоях и вариабельная степень глиоза. В гранулярном слое зубчатой извилины может отмечаться разная степень снижения плотности нейронов, хотя в целом ее структура более сохранна в сравнении с СА слоями. Также отличительной гистологической особенностью является то, что выпадение нейронов не выходит за пределы СА слоев на субикулюм, что отличает склероз гиппокампа от его атрофии при ишемических повреждениях и нейродегенеративных заболеваниях. Было отмечено, что выпадение нейронов в пирамидальном слое гиппокампа может возникать в нескольких вариантах, что явилось основой для формирования классификации данной патологии. Наибольшее распространение получила классификация склероза гиппокампа, созданная комиссией ILAE. При СГ первого типа (выраженном или классическом) нейрональное выпадение наблюдается во всех слоях гиппокампа, 2 тип характеризуется выпадением нейронов преимущественно в СА1 слое и при 3 типе СГ поражен только СА4 слой в области перехода в зубчатую извилину (так называемый end folium склероз). В литературе наряду с термином склероз гиппокампа часто фигурирует ряд определений, которые подчеркивают, что гистологические признаки нарушенного строения мозговой ткани могут выходить за пределы гиппокампа.
Так термин «мезиальный темпоральный склероз», учитывает тот факт, что наряду с гиппокампом атрофические и глиотические изменения наблюдаются в амигдале и крючке. При анализе гистологического материала, полученного при хирургии височной эпилепсии, стало очевидным, что склероз гиппокампа сопровождается патогистологическими изменениями и в латеральном неокортексе височной доли. Thom предложила термин «височный склероз», при котором определяется выпадение нейронов и глиоз во 2-3 слоях височной коры. Довольно часто в неокортексе выявляются гетеротопированные нейроны в 1 ом слое коры и белом веществе, что обозначают термином «микродисгенезии». Комиссия ILAE в 2011 году представила новую классификацию фокальных кортикальных дисплазий, где была выделена группа ФКД 3а типа, когда склероз гиппокампа может сочетаться с дисплазией коры височной доли в виде нарушения ее ламинарного строения, которое в свою очередь классифицируется как ФКД 1ого типа. Микродисгенезии, роль которых в эпилептогенезе еще не известна, отнесены к так называемым малым мальформациям коры головного мозга и при их выявлении со склерозом гиппокампа диагноз определяется как ФКД 3а типа. Так же как ФКД 3а рассматривается сочетание височного склероза и склероза гиппокампа. В литературе часто встречается понятие «двойная патология» (dual pathology), когда склероз гиппокампа сочетается с потенциально эпилептогенным поражением неокортекса в том числе и вне височной доли, например, опухолью, сосудистой мальформацией, ФКД 2 типа, энцефалитом Рассмуссена, глиотическим рубцом. При этом в понятие «двойная патология» не входит ФКД 3а типа. Терминология становится еще более комплексной, поскольку наличие двух эпилептогенных поражений мозга, но без склероза гиппокампа обозначают как double pathology.
Для понимания связей между различными отделами гиппокампа и патогенеза при СГ необходимо иметь представление о строении полисинаптического интрагиппокампального пути, который начинается от нейронов 2 слоя энторинальной коры (расположенной в передней части парагиппокампальной извилины и в области крючка). Отростки этих нейронов образуют перфорантный путь, который идет через субикулюм парагиппокампальной извилины в зубчатую извилину и контактирует с дендритами клеток гранулярного слоя. Нейроны гранулярного слоя формируют мшистые волокна, иннервирующие СА3 и СА4 пирамидальные нейроны, которые в свою очередь через боковые аксоны, так называемые коллатерали Шаффера контактируют с СА1 слоем. Аномальное прорастание мшистых волокон вместо СА слоев в зубчатую извилину с формированием возбуждающих синапсов считается одним из патогенетических звеньев при СГ. Из вышеперечисленных СА слоев аксоны входят в альвеус и затем в свод мозга через фимбрию гиппокампа. Учитывая анатомическую и функциональную связь между Аммоновым рогом, зубчатой извилиной, субикулюмом, ряд авторов обозначил их термином «гиппокампальная формация».
Причины склероза гиппокампа
Центральным вопросом этиологии СГ является выяснение того, что возникает первично: структурная патология гиппокампа, запускающая хроническую фармакорезистентную эпилепсию или же наоборот длительная патологическая электрическая активность со временем приводит к склерозу. Важно отметить, что существенная часть больных с ФР эпилепсией, связанной с СГ, переносит в раннем детстве статус фебрильных судорог или другую острую патологию ЦНС (травму, аноксию, нейроинфекцию), что получило обозначение как начальное преципитирующее повреждение. В пользу приобретенного характера СГ, говорят и те редкие наблюдения, когда данная патология возникает у одного из монозиготных близнецов, второй близнец не имеет склероза, а, следовательно, генетический фактор не является первостепенным. Тем не менее, наследственных семейных форм височной эпилепсии (например, группа эпилепсий, связанных с мутациями генов SCN1a и SCN1b, кодирующих натриевые) указывает на то, что генетический фактор также играет свою роль, обуславливая у части таких пациентов склероз гиппокампа без фебрильных приступов в анамнезе. Говоря о приобретенном характере болезни, также следует учитывать, что не всякий тип приступов связан с развитием СГ: данные аутопсии свидетельствуют, что длительно текущая неконтролируемая эпилепсия с частыми генерализованными приступами не приводит к нейрональному выпадению в гиппокампе, так же как и афебрильный эпилептический статус. С другой стороны, фебрильный эпилептический статус сопровождается МРТ признаками отека гиппокампа. Ответ на вопрос как часто статус фебрильных судорог у ребенка реализуется в СГ и фармакорезистентную эпилепсию возможно даст проспективное исследование FEBSTAT. Уже было установлено, что из 226 детей после статуса фебрильных судорог у 22 наблюдались МРТ признаки отека гиппокампа, наиболее выраженные в секторе Зоммера (СА1). Из этих 22 больных повторное МРТ в различные сроки выполнялось у 14 при этом в 10 случаев были выявлены признаки склероза гиппокампа. Тем не менее, из 226 детей эпилепсия была диагностирована только у 16 пациентов и в большинстве случаев она была невисочная. Т.е с одной стороны фебрильный статус не всегда приводит к эпилепсии со склерозом гиппокампа, с другой стороны временной интервал между преципитирующей травмой мозга и появлением височной эпилепсии может быть больше 10 лет, а катамнеза такой длительности исследование пока не имеет. Генетические исследования так же свидетельствуют о том, что этиология СГ является гетерогенной. Изучение полногеномных ассоциаций показало, что фебрильные приступы со склерозом гиппокампа могут быть генетическим синдромом, так как они связаны с наличием специфического аллеля однонуклеотидной последовательности, расположенной рядом с геном натриевого канала SCN1A. Такой ассоциации не было выявлено для случаев эпилепсии с СГ без фебрильных приступов. Консенсусным мнением эпилептологов является то, что существует некая исходная генетическая предрасположенность, которая реализуется в склероз гиппокампа при наличии определенного повреждающего фактора (гипотеза двойного удара).
Патогенез склероза гиппокампа
Гиппокамальный склероз имеет две принципиальные патологические характеристики: первая — это резкое снижение числа нейронов и вторая – это гипервозбудимость оставшейся нервной ткани. Одну из ключевых ролей в эпилептогенезе при СГ играет спрутинг мшистых волокон: аномальные аксоны гранулярных клеток вместо иннервации СА клеток гиппокампа реиннервируют молекулярные нейроны зубчатой извилины через возбуждающие синапсы, создавая, таким образом, локальные электрические цепи способные к синхронизации и генерации эпиприступа. Увеличение количества астроцитов, глиоз также может играть роль в эпилептогенезе, т.к. измененные астроциты не могут в достаточной мере осуществлять обратный захват глутамата и калия. Через механизм увеличения выброса глутамата и снижения обратного захвата, ингибиции ГАМК, могут действовать и провоспалительные цитокины, такие как IL-1β, IL 1, TNFa. В этом отношении в патогенезе СГ обсуждается роль вируса герпеса 6 типа, ДНК которого обнаруживается в мозговой ткани у пациентов с височной эпилепсией.
Клиника и диагностика
История болезни при эпилепсии, обусловленной склерозом гиппокампа, описана, главным образом, на основе многочисленных исследований по оценке эффективности хирургического лечения височной эпилепсии. Частым событием в анамнезе является указание на перенесенную в детстве (как правило, до 5 лет) острую патологию ЦНС: статус фебрильных судорог, нейроинфекцию, ЧМТ. Стереотипные приступы начинаются в период от 6 до 16 лет, при этом может иметь место так называемый латентный период, который определяется временем между начальным преципитирующим повреждением и развитием первого эпиприступа. Также нередки ситуации, когда между первым припадком и развитием фармакорезистентности, проходит период, обозначаемый как «молчащий». Такая особенность течения заболевания указывает на его прогрессивный характер. Характерным когнитивным дефицитом при СГ может быть снижение памяти, особенно при неконтролируемых приступах.
Диагностика эпилепсии, обусловленной склерозом гиппокампа, базируется на трех основных принципах. Первое – это детальный анализ последовательности симптомов в эпилептическом приступе или семиологии, которая зависит от того в какие участки мозга распространяется эпилептическая активность. Второе – анализ данных ЭЭГ и сопоставление их с семиологией приступа и третье — выявление эпилептогенного поражения на МРТ. Говоря о семиологии приступа при височной эпилепсии, связанной с СГ, необходимо помнить, что во-первых, каждый из симптомов по отдельности не является специфичным, хотя и существует типичная закономерность протекания приступа. Во-вторых, симптомы в приступе появляются при распространении эпилептической активности в отделы мозга, связанные с гиппокампом, который сам по себе не дает клинических проявлений. Характерным началом височного приступа является аура в виде восходящего ощущения в животе. Также возможен страх или тревога при вовлечении в начале приступа амигдалы. В начале приступа может отмечаться ощущение “уже виденного” (déjà vu). Настораживающей в плане диагностики является аура в виде головокружения или шума, что может говорить о экстрагиппокампальном начале приступа. Сохранная способность называть предметы и говорить во время приступа является важным латерализующим признаком поражения недоминантного полушария. Изменение сознания сопровождается остановкой деятельности при этом пациент имеет застывший взгляд с широко открытыми глазами (таращение — starring). Следующим симптомом за аурой, остановкой деятельности идут автоматизированные действия: ороалиментраные автоматизмы с жеванием, чмоканьем губами. Также нередко возникает контрлатеральная стороне склерозированного гиппокампа дистония в руке, что связанно с распространением эпиактивности в базальные ганглии и также появляющиеся при этом мануальные автоматизмы в виде перебирания предметов кистью в ипсилатеральной руке. Среди латерализующих симптомов важное значение имеют постиктальный парез, который указывает на вовлечение контрлатерального полушария и постиктальная афазия при поражении доминантного полушария. Указанные симптомы должны рассматриваться в контексте данных ЭЭГ.
Основой электроклинической диагностики при склерозе гиппокампа является видеоЭЭГ мониторинг, заключающийся в одновременной видео регистрации эпилептического приступа и электрической активности головного мозга. ВидеоЭЭГ мониторинг решает несколько задач: 1. Он позволяет исключить псевдоприступы и неэпилептические пароксизмы, в том числе и при их сочетании с действительно имеющейся эпилепсией 2. Дает возможность детальной оценки семиологии приступа и сопоставления ее с динамикой приступной эпиактивности: ее латерализации и региональной локализации, 3. Длительная запись позволяет выяснить латерализацию и локализацию межприступной активности. Наиболее удачным вариантом в плане благоприятного исхода хирургии эпилепсии является совпадение латерализующих и локализующих симптомов в приступе с данными иктальной и интериктальной ЭЭГ и МРТ картиной. Острым вопросом в предхирургическом обследовании является то, как долго должен проводится видеоЭЭГ мониторинг. Известно, что вероятность зарегистрировать пароксизм на 30 минутной ЭЭГ при частоте приступов 1 раз в неделю составляет около 1%, а длительный видеоЭЭГ мониторинг со средней продолжительностью в 7 дней не выявляет межприступной активности у 19 % пациентов. Острый вопрос в предхирургическом обследовании при височной эпилепсии касается необходимой длительности видеоЭЭГ мониторинга: является ли жестким требованием обязательная фиксация иктальных событий на ЭЭГ или же решение о хирургии может быть принято на основании анализа интериктальной активности. Ряд эпилептологов полагают, что при характерной клинической картине и истории заболевания, наличии склероза гиппокампа на МРТ регистрация иктального события не обязательна при более чем 90% латерализации интериктальной эпиактивности в височном регионе на стороне поражения по МРТ. В большинстве случаев, разрешающей способности скальповой ЭЭГ достаточно, для того чтобы правильно латерализовать зону начала приступа при височной эпилепсии и в контексте согласующихся семиологии приступа и МРТ данных определить стратегию хирургического лечения.
МРТ диагностика склероза гиппокампа является следующим принципиальным этапом предхирургического обследования и должно выполняться по эпилептологическому протоколу, среди основных характеристик которого можно выделить небольшую толщина срезов и высокая сила магнитного поля. Оптимальным условием для эпилептологического МРТ является взаимодействие между эпилептологом и рентгенологом, когда планирование исследования проводится с учетом предполагаемой локализации эпилептогенной зоны. Склероз гиппокампа на МРТ имеет характерные признаки: уменьшение объема гиппокампа и нарушение структуры СА слоев, гиперинтенсивный сигнал в режиме Т2 и FLAIR. Нередко выявляются атрофические изменения в ипсилатеральных амигдале, полюсе височной доли, форниксе, маммилярном теле. В задачи высокоразрешающего МРТ также входит обнаружение другой эпилептогенной патологии головного мозга, расположенной вне гиппокампа, т.е двойной патологии, например, фокальной кортикальной дисплазии, что делает неэпилептологическое МРТ исследование недостаточным для принятия решения о хирургии, даже если на нем выявлены признаки склероза гиппокампа.
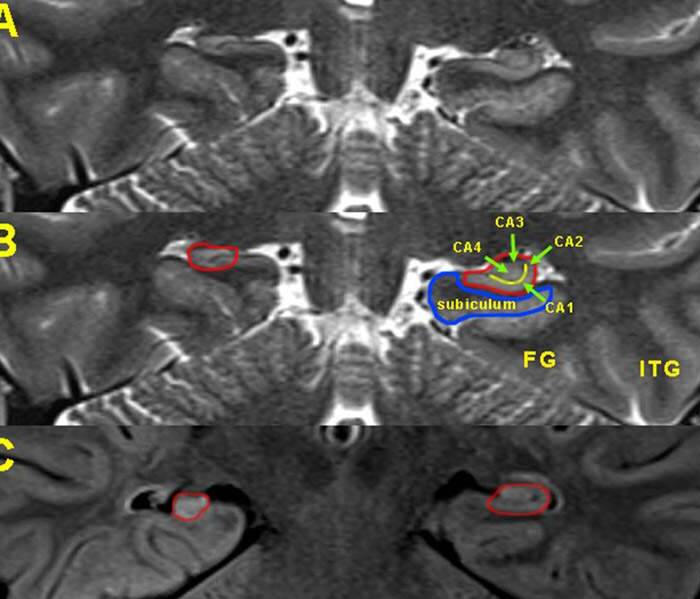
МРТ анатомия нормального и склерозированного гиппокампа
A –Т2 коронарный срез: склероз правого гиппокампа, определяется уменьшение его объема, отсутствие внутренней структуры по сравнению с левым гиппокампом. B – тот же срез с пояснениями. Красной линией обведены гиппокампы (видно уменьшение объема правого гиппокампа,), синей линией — субикулум слева. Желтая линия в центре гиппокампа проведена вдоль глубокой части гиппокампальной борозды (на рисунке А в правом гиппокампе эта борозда не определяется). FG – фузиформная извилина, ITG – нижняя височная извилина. С – коронарный срез в режиме FLAIR, видно снижение объема и гиперинтенсивный сигнал от правого гиппокампа.
Принципиальным моментом в понимании электрофизиологии медиальной височной эпилепсии является тот факт, что сама по себе скальповая ЭЭГ не выявляет эпиактивность в гиппокампе, что было продемонстрировано в многочисленных исследованиях с применением внутримозговых электродов, т.е для появления эпиактивности на скальповой ЭЭГ в височном регионе требуется ее распространение из гиппокампа на прилежащую кору височной доли. При этом основные клинические проявления приступа при медиальной височной эпилепсии связаны с распространением эпиактивности вне гиппокампа: déjà vu связано с возбуждением энторинальной коры, чувство страха – с амигдалой, абдоминальная аура — с островком, ороалиментарные автоматизмы с островком и лобным оперкулумом, дистония в контрлатеральной руке — с распространением возбуждения на ипсилатеральные базальные ганглии. Эти анатомоэлектрофизиологические особенности могут обуславливать наличие у пациента приступов очень похожих на височные пароксизмы, однако реально имеющих экстрагиппокампальное и экстратемпоральное начало. По мере накопления опыта хирургического лечения височной эпилепсии стало очевидным, что удаление медиальных структур височной доли позволяет избавиться от приступов полностью у 50 – 90% пациентов, однако в части случаев частота приступов никак не меняется. Данные исследований электрической активности мозга с помощью внутримозговых электродов и анализ неудачных исходов операций показали, что в ряде случаев причиной сохранения приступов после удаления СГ является наличие более обширной эпилептогенной зоны, которая выходит за пределы гиппокампа. Отделы мозга анатомически и фунционально связанные с гиппокампом, такие как островок, орбито-фронтальная кора, теменной оперкулюм, стык теменной височной затылочной долей, могут генерировать приступы похожие по клинической и ЭЭГ картине на височные пароксизмы. Была предложена концепция «височной эпилепсии плюс» (лучше височно-пересильвиевые (патрик очень не любит плюс)) для описания ситуаций, когда склероз гиппокампа существует наряду с экстратемпоральной зоной инициации приступа. В этом отношении немаловажным является определение показаний к инвазивному ЭЭГ исследованию при височной эпилепсии, обусловленной склерозом гиппокампа. Настораживающими симптомами являются вкусовая аура, аура в виде вертиго, шума. Интериктальная эпиактивность чаще локализуется билатерально в височных областях или в предцентральном регионе. Иктально эпиактивность при темпоральных плюс формах чаще отмечается в передне лобных, темпоропариетальных и предцентральных областях. Дифференциальная диагностика височной эпилепсии от височной эпилепсии плюс, проводимая квалифицированным эпилептологом, является ключевой в планировании хирургического вмешательства и прогнозировании исхода лечения.
Лечение эпилепсии, связанной со склерозом гиппокампа
Стандартом оказания медицинской помощи больным с фармакорезистентной медиальной височной эпилепсией является направление в центр, специализированный в предхирургическом обследовании и оперативном лечении эпилепсии. Среди колоссального количества публикаций, подтверждающих эффективность хирургии височной эпилепсии, целесообразно отметить два ключевых исследования с максимальным уровнем доказательности. Wiebe и соавт. в 2001 году провели рандомизированное контролируемое исследование (РКИ), которое показало, что хирургия височной эпилепсии при склерозе гиппокампа позволяет избавиться от приступов в 58 % случаев при сравнении с медикаментозной терапией (лишь 8%). Основой для другого исследования послужил тот факт, что средняя длительность болезни у пациентов, получивших хирургическое лечение составляет 22 года и при этом между постановкой диагноза фармакорезистеной эпилепсии (неэффективность двух противосудорожных лекарств) и хирургическим лечением существует задержка более чем 10 лет. Engel и соавт. показали в мультицентровом РКИ, что дальнейшее продолжение фармакотерапии после неэффективности двух лекарств при МВЭ не сопровождается ремиссией приступов в отличии от хирургического лечения после констатации неэффективности двух препаратов (11 из 15 пациентов без приступов).
Двумя очевидными целями хирургии височной эпилепсии являются: 1. избавление пациента от приступов, 2. отмена лекарственной терапии или уменьшение дозировки (т.е возможен исход, когда для полного контроля приступов необходимо продолжать принимать АЭП). По данным литературы около 20% перестают принимать лекарства, 50 % остаются на монотерапии и 30 % получают политерапию. Третья цель, менее очевидная, но имеющая принципиальное значение, состоит в снижении риска внезапной необъяснимой смерти при эпилепсии (SUDEP – sudden unexplained death in epilepsy), которая связана с резким рефлекторным угнетением кардиореспираторной функции у больных с фармакорезистентными эпиприступами.
В задачу хирургического лечения височной эпилепсии входит полное удаление эпилептогенной коры головного мозга с максимальным сохранением функциональных участков мозга и минимизации нейропсихологического дефицита. В этом отношении существует два принципиальных хирургических подхода: височная лобэктомия и селективная амигдалогиппокампэктомия. Обе операции включают в себя удаление крючка, амигдалы и гиппокампа. Селективный доступ к медиальному виску может быть выполнен через несколько различных подходов, височная лобэктомия подразумевает также удаление латерального неокортекса височной доли (от 3-х до 5 см в зависимости от доминантности полушария). Сторонники селективного подхода исходят из того предположения, что сохранение латерального неокортекса позволяет минимизировать нейропсихологический дефицит, в частности снижение вербальной памяти. С другой стороны, как уже было отмечено, патологические изменение могут выходить за пределы гиппокампа в амигдалу, полюс височной доли и латеральный неокортекс. Инвазивные ЭЭГ исследования с помощью глубинных электродов показали, что при склерозе гипоккампа в 35% случаев эпиактивность возникает в полюсе височной доле, прежде чем в гиппокампе. Также на основе анализа данных глубинных электродов выделено несколько типов височных эпилепсий: медиальная, медиально-латеральная, темпорополярная и уже упоминавшаяся «височная эпилепсия плюс». Таким образом, при выборе тактики хирургического лечения следует учитывать вероятность наличия более обширной эпилептогенной зоны, выходящей за пределы склерозированного гиппокампа. На сегодняшний момент отсутствуют данные 1 класса доказательности, демонстрирующие преимущество какой-либо из методик в контроле приступов, нейропсихологическом исходе или частоте случаев необходимости послеоперационного приема АЭП для контроля приступов, поэтому выбор операции зависит от предпочтений хирурга.
Хирургия височной эпилепсии при склерозе гиппокампа при достаточном опыте хирурга несет минимальные риски неврологического дефицита (постоянный гемипарез менее 1%, полная гемианопсия – 0,4%). До конца не решенной проблемой остается определение риска ухудшения памяти после хирургии височной доли. Известно, что после резекции гиппокампа доминантного по речи полушария около 35% пациентов демонстрируют худшие показатели при проведении нейропсихологических тестов по оценке вербальной памяти. Риск снижения вербальной памяти повышен в случае позднего начала заболевания, высоких предоперационных показателей по тестам, СГ в доминантном полушарии, минимальных изменений гиппокампа на МРТ, что в целом отражает тот факт, что эпилептогенный гиппокамп зона может сохранять функциональность. Тем не менее, сложно определить, насколько это снижение по выполнению тестов влияет на послеоперационное качество жизни, которое зависит степени контроля приступов после хирургии, тяжести сопутствующих депрессивных и тревожных расстройств. Определение показаний к хирургии в случаях пациентов высокого риска должно проводиться с особенной аккуратностью, поскольку при неудачном эпилептологическом исходе пациент также будет испытывать и когнитивный дефицит, что резко снижает его качество жизни. В этой связи следует подчеркнуть, что необходимым условием организации хирургической помощи больным с эпилепсией является формирование командного подхода к каждому клиническому случаю, что требует тесного взаимодействия между эпилептологом, хирургом, нейрорентгенологом и нейропсихологом.
Список литературы
- Thom M. Hippocampal sclerosis: progress since Sommer. Brain Pathol. Oct 2009;19(4):565-572.
- Thom M. Review: Hippocampal sclerosis in epilepsy: a neuropathology review. Neuropathol Appl Neurobiol. Aug 2014;40(5):520-543.
- Duvernoy H. The human hippocampus. Functional anatomy, vascularization and serial sections with MRI. Springer-Verlag Berlin Heidelberg. 2013.
- Thom M, Eriksson S, Martinian L, et al. Temporal lobe sclerosis associated with hippocampal sclerosis in temporal lobe epilepsy: neuropathological features. J Neuropathol Exp Neurol. Aug 2009;68(8):928-938.
- Wieser HG. ILAE Commission Report. Mesial temporal lobe epilepsy with hippocampal sclerosis. Epilepsia. Jun 2004;45(6):695-714.
- Blumcke I, Thom M, Aronica E, et al. International consensus classification of hippocampal sclerosis in temporal lobe epilepsy: a Task Force report from the ILAE Commission on Diagnostic Methods. Epilepsia. Jul 2013;54(7):1315-1329.
- Blumcke I, Thom M, Aronica E, et al. The clinicopathologic spectrum of focal cortical dysplasias: a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission. Epilepsia. Jan 2011;52(1):158-174.
- Karatas H, Dericioglu N, Saygi S. Mesial temporal lobe epilepsy with hippocampal sclerosis in two pairs of identical twins. Bratisl Lek Listy. 2012;113(7):441-444.
- Abou-Khalil B, Ge Q, Desai R, et al. Partial and generalized epilepsy with febrile seizures plus and a novel SCN1A mutation. Neurology. Dec 26 2001;57(12):2265-2272.
- Thom M, Zhou J, Martinian L, Sisodiya S. Quantitative post-mortem study of the hippocampus in chronic epilepsy: seizures do not inevitably cause neuronal loss. Brain. Jun 2005;128(Pt 6):1344-1357.
- Scott RC, Gadian DG, King MD, et al. Magnetic resonance imaging findings within 5 days of status epilepticus in childhood. Brain. Sep 2002;125(Pt 9):1951-1959.
- Lewis DV, Shinnar S, Hesdorffer DC, et al. Hippocampal sclerosis after febrile status epilepticus: the FEBSTAT study. Ann Neurol. Feb 2014;75(2):178-185.
- Kasperaviciute D, Catarino CB, Matarin M, et al. Epilepsy, hippocampal sclerosis and febrile seizures linked by common genetic variation around SCN1A. Brain. Oct 2013;136(Pt 10):3140-3150.
- O’Dell CM, Das A, Wallace Gt, Ray SK, Banik NL. Understanding the basic mechanisms underlying seizures in mesial temporal lobe epilepsy and possible therapeutic targets: a review. J Neurosci Res. May 2012;90(5):913-924.
- Theodore WH, Epstein L, Gaillard WD, Shinnar S, Wainwright MS, Jacobson S. Human herpes virus 6B: a possible role in epilepsy? Epilepsia. Nov 2008;49(11):1828-1837.
- Ozkara C, Aronica E. Hippocampal sclerosis. Handb Clin Neurol. 2012;108:621-639.
- Kahane P, Landre E, Minotti L, Francione S, Ryvlin P. The Bancaud and Talairach view on the epileptogenic zone: a working hypothesis. Epileptic Disord. Aug 2006;8 Suppl 2:S16-26.
- Bartolomei F, Barbeau EJ, Nguyen T, et al. Rhinal-hippocampal interactions during deja vu. Clin Neurophysiol. Mar 2012;123(3):489-495.
- Sundaram M, Sadler RM, Young GB, Pillay N. EEG in epilepsy: current perspectives. Can J Neurol Sci. Nov 1999;26(4):255-262.
- Goodin DS, Aminoff MJ. Does the interictal EEG have a role in the diagnosis of epilepsy? Lancet. Apr 14 1984;1(8381):837-839.
- Cendes F, Li LM, Watson C, Andermann F, Dubeau F, Arnold DL. Is ictal recording mandatory in temporal lobe epilepsy? Not when the interictal electroencephalogram and hippocampal atrophy coincide. Arch Neurol. Apr 2000;57(4):497-500.
- Javidan M. Electroencephalography in mesial temporal lobe epilepsy: a review. Epilepsy Res Treat. 2012;2012:637430.
- Kahane P, Bartolomei F. Temporal lobe epilepsy and hippocampal sclerosis: lessons from depth EEG recordings. Epilepsia. Feb 2010;51 Suppl 1:59-62.
- Barba C, Barbati G, Minotti L, Hoffmann D, Kahane P. Ictal clinical and scalp-EEG findings differentiating temporal lobe epilepsies from temporal ‘plus’ epilepsies. Brain. Jul 2007;130(Pt 7):1957-1967.
- Wiebe S, Blume WT, Girvin JP, Eliasziw M. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. Aug 2 2001;345(5):311-318.
- Engel J, Jr., McDermott MP, Wiebe S, et al. Early surgical therapy for drug-resistant temporal lobe epilepsy: a randomized trial. JAMA. Mar 7 2012;307(9):922-930.
- Massey CA, Sowers LP, Dlouhy BJ, Richerson GB. Mechanisms of sudden unexpected death in epilepsy: the pathway to prevention. Nat Rev Neurol. May 2014;10(5):271-282.
- Josephson CB, Dykeman J, Fiest KM, et al. Systematic review and meta-analysis of standard vs selective temporal lobe epilepsy surgery. Neurology. Apr 30 2013;80(18):1669-1676.
- Chabardes S, Kahane P, Minotti L, et al. The temporopolar cortex plays a pivotal role in temporal lobe seizures. Brain. Aug 2005;128(Pt 8):1818-1831.
- Salanova V, Markand O, Worth R. Temporal lobe epilepsy surgery: outcome, complications, and late mortality rate in 215 patients. Epilepsia. Feb 2002;43(2):170-174.
- Binder JR, Sabsevitz DS, Swanson SJ, Hammeke TA, Raghavan M, Mueller WM. Use of preoperative functional MRI to predict verbal memory decline after temporal lobe epilepsy surgery. Epilepsia. Aug 2008;49(8):1377-1394.
- Elshorst N, Pohlmann-Eden B, Horstmann S, Schulz R, Woermann F, McAndrews MP. Postoperative memory prediction in left temporal lobe epilepsy: the Wada test is of no added value to preoperative neuropsychological assessment and MRI. Epilepsy Behav. Oct 2009;16(2):335-340.

